Différentes façons d'étudier les cellules:
La culture cellulaire
La culture cellulaire in vitro (vivante) concerne :
-Les cultures primaires : c’est-à-dire des cellules prélevées sur un être vivant
et que l’on met en culture in vitro mais qui ne peuvent pas être maintenues sur
une longue durée de temps avec une prolifération élevée (entre autre, parce
qu’elles atteignent la limite de Hayflick1 où elles entrent en
sénescence, à cause du raccourcissement des télomères2 à chaque
réplication).
-Les lignées cellulaires : c’est-à-dire des cellules prélevées sur un être
vivant il y a longtemps et qui maintiennent des capacités de prolifération
théoriquement illimitées (parce qu’elles sont cancéreuses, ou parce qu’elles ont
des propriétés de cellules souches ou parce qu’elles ont été « immortalisées »
en leur faisant exprimer un gène cancéreux (oncogène). On utilise souvent
l’antigène T du virus SV40 qui inhibe Rb et p53 qui sont des gènes suppresseur
de tumeur et protecteur de l'ADN.

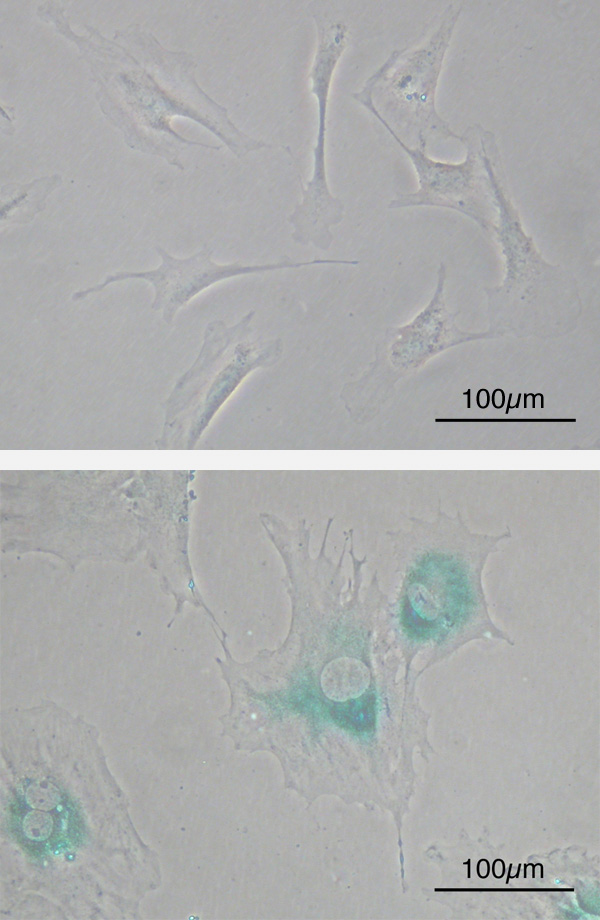
Test de sénescence dans des cultures de fibroblastes de souris embryonnaires (MEF) ou test SABG. (En haut) Avant la sénescence, MEF au 2ème passage après prélèvement. Les MEF ont une forme de fuseau. (En bas) Après le 8ème passage, les MEF se sont agrandis et se sont aplatis. La coloration bleu-vert indique l’expression de la β-galactosidase associée à la sénescence (la coloration est obtenue en présence du substrat X-gal). Source : https://en.wikipedia.org/wiki/Cellular_senescence#/media/File:SABG_MEFs.jpg
Des stocks de lignées cellulaires peuvent être conservées « indéfiniment » dans
de l’azote liquide (cryoconservation à -196°C).
La culture cellulaire présente de nombreux avantages mais aussi des
inconvénients. Les cellules sont dans un environnement contrôlé (température,
nutriments disponibles, éventuellement matrice extracellulaire…) mais cet
environnement est parfois éloigné des conditions physiologiques. Dans des
cultures classiques en 2D chaque cellule est facilement visible, mais les
propriétés des organisations 3D dans les tissus peuvent être perdues. Les
capacités importantes de prolifération, notamment des lignées cellulaires
utilisées permettent d’obtenir beaucoup de matériel pour faire des études de
biochimie et facilitent les analyses statistiques mais une fois de plus les
cellules ne sont pas dans leur cadre naturel et des cellules très proliférantes
ne correspondent qu’à un profil particulier de cellules.
La culture cellulaire permet de diminuer le recours à l’expérimentation animale
mais ne peut pas la remplacer complètement.
Les cellules sont cultivées sur du plastique traité pour que les cellules
puissent y adhérer ou sur des éléments de matrice extracellulaire que l’on
dépose avant d’ensemencer les cellules (collagène, fibronectine ou Matrigel
(lame basale produite par des cellules de sarcome de souris)). Les cellules sont
cultivées dans un milieu nutritif contenant des nutriments et des vitamines et
souvent additionné de sérum (en général sérum de veau foetal) dans lequel se
trouvent des facteurs de croissance nécessaire à la prolifération. Pour les
cellules qui prolifèrent, on suit le niveau de confluence, c’est-à-dire le
pourcentage de la surface couvert par les cellules.
Des nouvelles technologies permettent un suivi en continu de l’adhérence, de la
prolifération et de la migration des cellules lors de la culture.
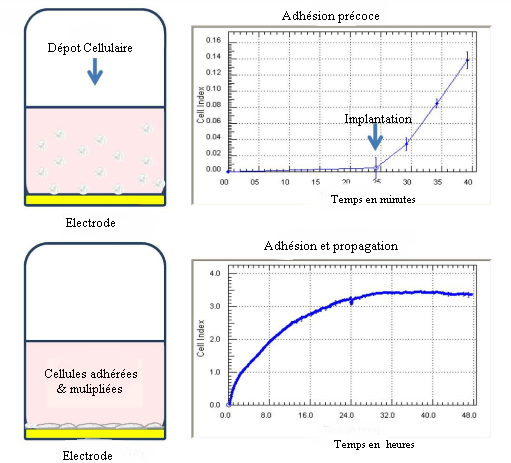
**Suivi en temps réel de l’adhérence et de la confluence des cellules par la
technologie xCELLigence qui est basée sur les variations de l’impédance (de la
résistance électrique) d’une couche riche en or qui dépend des cellules qui sont
attachées sur le substrat. Ces modifications d’impédance sont traduites en un « cell
index » qui est nul si aucune cellule n’est attachée. Des changements dans la
morphologie cellulaire (adhérence, étalement), le nombre de cellules
(prolifération ou mort) ou la migration peuvent être étudiés à l’aide de ce
système. En haut, on suit l’adhérence initiale de cellules que l’on vient de
disperser dans le milieu de culture. En bas, à plus long terme, on peut suivre
l’étalement des cellules. Ici, les cellules ne prolifèrent pas, mais si elles
proliféraient on observerait une pente ascendante au lieu d’un plateau.
Source : https://www.mdpi.com/2079-6374/5/2/199/htm
1La limite ultime de Hayflick » est d’environ 125 ans pour les
humains , au-delà de laquelle aucun régime alimentaire, aucun exercice physique,
ni même aucune modification génétique contre les maladies ne peut prolonger la
durée de vie humaine.
2:Le noyau contient les chromosomes, au bout desquels il y a les télomères. À chaque division cellulaire, les télomères raccourcissent et deviennent moins efficaces.
Immunoprécipitation:
L'Immunoprécipitation est une technique qui permet d’isoler une protéine d’un
extrait cellulaire et tous les interactants directs ou indirects avec cette
protéine grâce à l’interaction très spécifique anticorps-antigène. Les anticorps
peuvent être fixés sur des billes et on peut récupérer les complexes formés
grâce à une centrifugation. Alternativement, on peut utiliser des billes qui
sont ensuite attirées par un aimant. L’enrichissement de la fraction
immunoprécipitée par rapport à la fraction initiale (souvent appelée input) peut
être appréciée par western-blot (voir: 1/ Technique d'analyse de la cellule
dans: Application en médecine par exemple dans la maladie d'Hutchington).
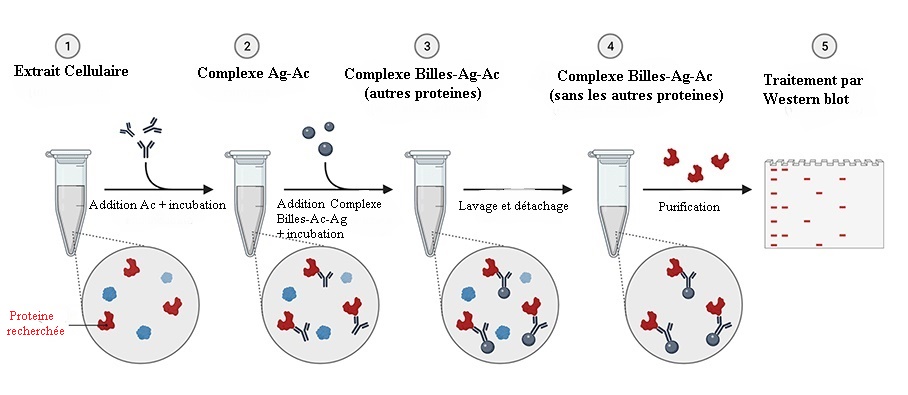
Cette technique permet de savoir si deux protéines A et B appartiennent à un
même complexe à un moment donné et dans des conditions données. On fait une
immunoprécipitation avec un anticorps contre A et on analyse la présence par
western-blot de la protéine B reconnue par un autre anticorps. Pour valider
complètement l’interaction, il est préférable aussi de montrer l’inverse
(immunoprécipitation de B et révélation de A).
L'utilisation de l'Immunoprécipitation
est un outil diagnostique qui permet de confirmer certaines pathologies en
mettant en évidence des marqueurs spécifiques d'une maladie. Dans la majorité
des cancers, il peut y avoir surexpression de certaines protéines. Souvent la
mutation
concerne le gène HER2 (ErbB2).
Ce
gène HER2 est un oncogène et génère une protéine située à la surface des
cellules. Ces cellules alors se développent et se multiplient avec
cette anomalie. Lorsqu'un cancer présente une quantité excessive de la protéine
HER2, on parle alors de surexpression de la HER2 ou de cancer HER2 positif.
Le double-hybride:
Ce système s'effectué chez la levure ou dans des cellules de mammifères pour
mettre en évidence que deux protéines peuvent interagir entre elles. Cette
méthodologie est basé sur le nature modulaire des facteurs de transcription qui
sont généralement composés de deux domaines : un domaine de liaison à l’ADN et
un domaine d’activation de la transcription. Chez la levure, on utilise le
facteur de transcription Gal41. Si on veut savoir si la protéine A
interagit avec la protéine B, on fait synthétiser aux cellules deux protéines de
fusion : une avec le domaine de liaison à l’ADN de Gal41 fusionné
avec la protéine A et une autre avec le domaine d’activation de Gal41
fusionné avec la protéine B. Ce n’est seulement dans le cas où A interagit avec
B que le domaine d’activation de la transcription se trouvera à proximité du bon
domaine de liaison à l’ADN et alors la transcription d’un gène rapporteur
(codant la luciférase2, la GFP ou une protéine indispensable à la
croissance des colonies de levure) sera activée.
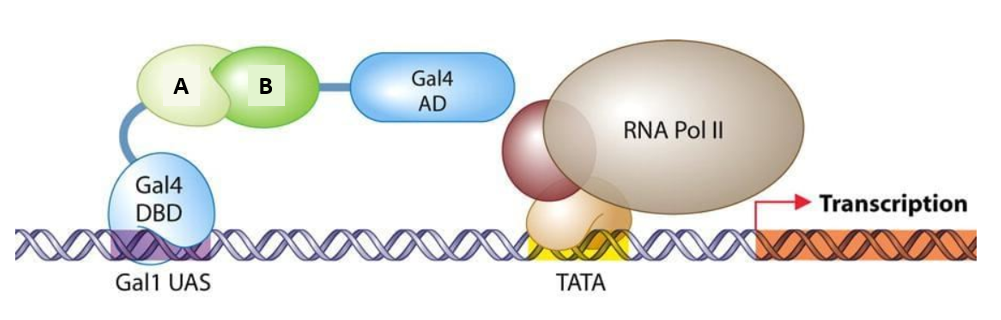
*Principe du double hybride. Les protéines fusion A-Gal4DBD (DBD = domaine de
fixation à l’ADN) et B-Gal4AD (AD = domaine d’activation) doivent interagir pour
que la transcription du gène rapporteur (en orange) puisse être activée.
Source : https://www.creative-biolabs.com/Mammalian-Two-hybrid-Service.html
1Le facteur de transcription Gal4 est un régulateur positif de l'expression des gènes induits par la présence de galactose . Cette protéine appartient à une grande famille de facteurs de transcription fongiques, la famille Gal4, qui comprend plus de 50 membres chez la levure Saccharomyces cerevisiae bien connue des boulangers et les oenologues.
2: La Luciférase est
une enzyme qui oxyde la luciférine (protéine) , en produisant de l'énergie
lumineuse sous forme de bioluminescence. La luciférase est très utilisée comme
marqueur d'expression des gènes. EN effet, la bioluminescence de détecte
et se mesurable très facilement (résultats qualitatifs et quantifiables).
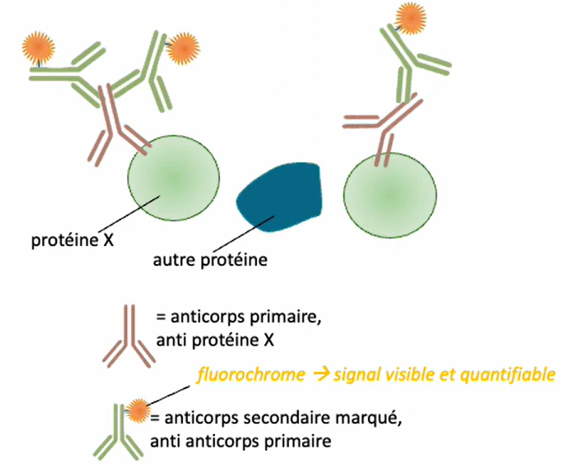
Immunohistochimie/Immunocytochimie/Immunofluorescence:
Comme pour le western-blot, ces techniques utilisent la spécificité de
reconnaissance des anticorps pour la mise en évidence des protéines d’intérêt
mais directement dans les cellules (cyto) ou des tissus (histo) qui ont été
fixés au préalable. Il y a alors une résolution spatiale particulièrement très
précise. L’immunohistochimie (IHC) est une technique d’histologie visant à
localiser une protéine donnée dans un tissu.
Principe de l’immunofluorescence. L’anticorps primaire dirigé contre la protéine
d’intérêt X est reconnu ensuite par un second anticorps dirigé contre
l’anticorps primaire et qui est couplé à un fluorochrome (ou fluorophore) qui
absorbe et émet des photons à des longueurs d’onde précises. L’utilisation de
deux anticorps permet une amplification du signal.
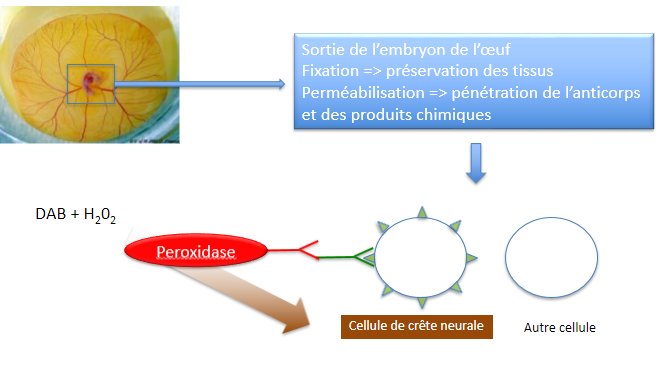
Source : https://www.youtube.com/watch?v=4wqaP-auiCc
On peut faire plusieurs détections d’immunofluorescence sur un même échantillon
à condition de bien choisir l’origine des anticorps (pas d’espèces communes pour
la production des différents anticorps primaires) et les longueurs d’onde des
fluorophores des anticorps secondaires.
L’immunohistochimie ou l’immunohistofluorescence peuvent se faire sur des tissus
entiers ou plus souvent sur des coupes. Pour réaliser ces coupes, les
échantillons fixés sont inclus dans de la paraffine pour les maintenir et sont
coupés au microtome.

Multiples coupes réalisées au microtome. L’échantillon visible en brun est
inclus dans la paraffine (grise) et montée sur un socle. Grâce à la manivelle,
ce socle est ensuite passé à la surface d’une lame de rasoir avec une légère
avancée qui permet de définir l’épaisseur de la coupe (entre 5 et 25 µm en
général). Plusieurs coupes peuvent être faites en série. Le pinceau est utilisé
pour maintenir les coupes et éviter qu’elles ne s’enroulent.
Alternativement, ils peuvent être inclus dans de l’OCT (un mélange d’alcool
polyvinylique et de polyéthylène glycol) et coupés à -20°C dans un cryostat).
Tissus inclus dans de l’OCT et prêts à être coupés finement (généralement entre
8 et 20 µm d’épaisseur) par une lame de cryostat (en bas à droite). Source :

Localisation de la myéline et de la microglie sur une coupe de cerveau humain par IHC.
https://histomics.institutducerveau.org/service/immunohistochimies/
L’amplification génique ou encore maintenant appelé « Test PCR » :
On utilise un artifice technique qui consiste à multiplier exponentiellement, grâce à une ADN polymérase, les séquences nucléotidiques recherchées au sein du prélèvement. La réaction se présente comme une succession de cycles identiques entre eux.
La première étape d’un cycle d’amplification est la dissociation des deux brins complémentaires d’ADN par un chauffage entre 92&95°C qui est la température de fusion de l’ADN qui consiste à casser les liaisons hydrogènes des deux brins complémentaires de l’ADN.
La deuxième étape est l’hybridation des amorces spécifiques qui sont de courtes séquences d’ADN complémentaires du gène recherché. Leur fixation se fait grâce à un abaissement de la température entre 50-55°C. Les amorces ont deux fonctions, le repérage de l’ADN recherché puis l’amorçage de la réplication de cet ADN par une ADN polymérase. Cette étape qui détermine la spécificité et l’efficacité de l’amplification, est le temps essentiel de la réaction.
La troisième étape est la réplication de l’ADN recherché. Cette réaction se fait actuellement avec une ADN polymérase supportant la chaleur (Taq polymérase provenant d’une bactérie thermophile). Grâce à cette thermo résistance, on peut enclencher un nouveau cycle de polymérisation sans nouvel ajout d’enzyme. Une fois le premier cycle achevé, on constate que la quantité d’ADN initial est multiplié par deux.
Si sur cette préparation, on recommence un cycle identique, la quantité de l’ADN est multiplié par quatre à la fin du deuxième cycle. En effet, lors de ce deuxième cycle, les brins d’ADN fabriqués lors du premier cycle servent de matrice à leur tour, et le processus se répète dans les cycles suivants.
L’amplification de l’ADN est donc, non pas linéaire mais exponentielle. La répétition de la procédure un nombre « n » de fois donne en théorie « 2n » copies du gène. En pratique, 30 à 40 cycles d’amplification multiplient la quantité d’ADN recherchées par un facteur de 100000 à 1000000. Cette méthode est automatisée. Les produits d’amplification sont ensuite analysés par électrophorèse sur gel d’agarose. Pour affirmer la recherche et éviter avoir un faux positif on hybride les produits d’amplification par une sonde ADN complémentaire afin de confirmer la spécificité.
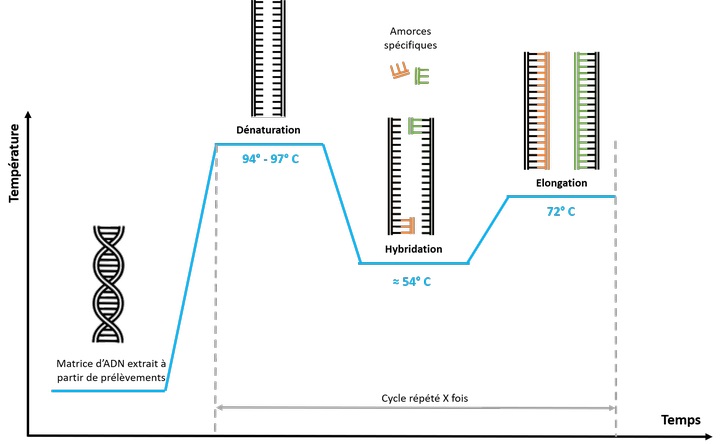
Source : https://www.biomnigene.fr/fr/nos-solutions/pcr.html
Il existe d'autres techniques d'études de la cellule:
-La microscopie et l'analyse des images utilisant le technique du FRAP
(Redistribution de fluorescence après photoblanchiment), le FLIP et le
FRET (Transfert d’énergie entre molécules fluorescentes) à permis la mise en
évidence spectaculaires du fonctionnement de la cellule.
-Les Approches optogénétiques qui perturbent la signalisation cellulaire.
-L'utilisation des rapporteurs fluorescents pour la concentration calcique.
-La cytométrie du flux.
-Les tests de migration cellulaire. qui utilise le Test de cicatrisation et ou
le test de migration en chambre de Boyden.
-Les marqueurs de prolifération tels que le BrdU,, le Ki-67 et le PCNA.
-La technique d'études du cycle cellulaire avec l'utilisation du FACS et ou du
système FUCCI.
1/ Technique d'analyse de la cellule
5/ Appareil de Golgi ou Dictyosome
13/ Complément sur la méthodologie de recherche en biologie cellulaire